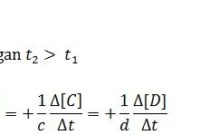Reaksi Redoks, Pengertian, Penyetaraan, Fungsi dan Contohnya – Dalam ilmu Kimia terdapat materi pembelajaran mengenai redoks. Redoks tersebut termasuk dalam jenis reaksi Kimia yang dapat disetarakan dengan menggunakan cara tertentu. Apa definisi reaksi redoks itu? Bagaimana cara menyetarakannya? Bagaimana cara menyelesaikan contoh soal reaksi ini? Apa saja yang contoh reaksi yang termasuk kategori redoks? Redoks tersebut merupakan singkatan dari reaksi oksidasi dan reaksi reduksi.
Tak semua siswa mampu menyelesaikan soal penyeteraan reaksi redoks dengan benar. Padahal apa yang dimaksud reaksi redoks dapat dijumpai dengan mudah di buku pedoman kimia. Dalam reaksi Kimia sendiri sering terjadi reaksi Oksidasi tertentu. Adapun kejadiannya yakni dalam reaksi kimia terdapat keterlibatan beberapa oksidasi atom dalam persamaan kimia yang melakukan perubahan saat reaksi kimia terjadi.
 |
| Konsep Penyetaraan Basa dengan Reaksi Redoks |
Materi redoks tersebut memberikan pembahasan mendasar mengenai konsep lain dalam kimia yang cukup penting yakni mengenai bilangan oksidasi. Seperti yang telah saya katakan di atas bahwa materi redoks dapat disetarakan dengan menggunakan beberapa metode. Pada kesempatan kali ini saya akan menjelaskan tentang pengertian reaksi redoks, penyetaraan reaksi redoks dan contoh reaksi redoksnya. Untuk lebih jelasnya dapat anda simak di bawah ini.
Reaksi Redoks, Pengertian, Penyetaraan, Fungsi dan Contohnya
Definisi reaksi redoks mengacu pada jenis reaksi kimia yang melibatkan pertukaran elektron antar zat. Secara etimologi ada dua proses yang terjadi pada saat zat saling bereaksi yakni reduksi dan oksidasi. Oksidasi terjadi apabila suatu zat kehilangan elektron sehingga menyebabkan peningkatan bilangan oksidan. Sedangkan reduksi terjadi ketika zat tersebut menerima elektron yang menyebabkan turunnya bilangan aksidan.
Tanpa sadar reaksi redoks memberi pengaruh besar pada aspek kehidupan manusia. Implementasinya pun bisa kita jumpai dengan mudah seperti pada baterai ponsel, terbentuknya karat, dan lain-lain. Namun faktanya tidak semua siswa tau saat ditanya apa pengertian reaksi redoks. Padahal baik definisi, penyetaraan, serta contoh reaksi redoks pasti akan muncul sebagai soal tes.
Inilah alasan mengapa dalam artikel singkat kali ini saya ingin membahas lebih dalam materi redoks. Selain mempelajari penyetaraan reaksi redoks, kalian juga akan saya suguhkan beberapa aspek materi lain. Sebeb pemahaman konsep reaksi redoks adalah kunci dalam menjelaskan banyak fenomena kimia dan proses industri yang kita temui sehari-hari.
Apa Itu Reaksi Redoks
Apa itu reaksi redoks ? Pertanyaan ini tentunya membuat kita semua penasaran mengingat yang kita bicarakan ini adalah salah satu reaksi kimia. Jika membicarakan kimia memang terkesan sangat komplek karena harus berurusan dengan angka dan rumus rumus senyawa, begitu juga dengan reaksi redoks yang akan kita bahas kali ini.
Pengertian reaksi redoks adalah sebuah bilangan oksidasi yang mengalami perubahan atau sebuah reaksi kimia yang atom atomnya dalam keadaan beroksidasi. Kata redoks sendiri merupakan singkatan dari kata reduksi maupun oksidasi. Adapun pengertian oksidasi ialah proses sebuah ion, molekul ataupun atom yang melepaskan sebuah elektron. Sedangkan pengertian reduksi ialah proses sebuah ion, molekul, ataupun atom yang menerima sebuah elektron.
Baca juga : Tekanan Osmosis (Pengertian, Rumus, Proses Terjadi, dan Contohnya)
Penyetaraan Reaksi Redoks
Selanjutnya saya akan menjelaskan tentang penyetaraan pada reaksi redoks. Penyetaraan reaksi redoks ini sebenarnya juga sudah dibahas di berbagai media baik itu cetak maupun online. Bahkan materi reaksi redoks ini juga menjadi materi wajib di mata pelajaran kimia SMA. Dalam materi redoks terdapat dua metode penyeteraan reaksinya. Adapun metode metodenya yaitu meliputi?
Metode Perubahan Biloks
Penyetaraan reaksi redoks yang pertama dapat menggunakan metode perubahan biloks. Adapun tata cara untuk menyetarakannya yaitu sebagai berikut:
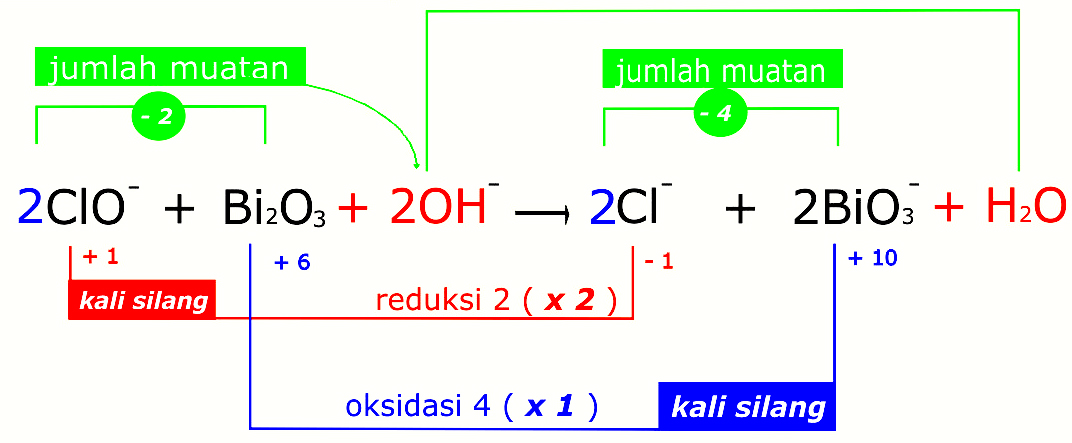
- Langkah pertama ialah melakukan identifikasi ion atau atom yang melakukan perubahan biloks dan menentukan masing masing biloksnya.
| Cara Menentukan Biloks |
- Pada perubahan biloksnya, kemudian bagian oksidasi ditulis jumlah elektron yang ingin dilepaskan dan bagian reduksinya ditulis jumlah elektron yang diterima.
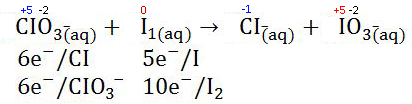 |
| Menulis Jumlah Elektronnya |
- Setelah itu pada bilangan bulatnya dihitung koefisien reaksi reaktan terkecil sehingga jumlah pengiriman elektron pada oksidasi dan reduksi dapat disetarakan. Setelah itu tahap dilanjutkan dengan mnyetarakan bagian produk dan koefisien rektannya.
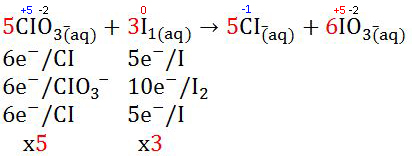 |
| Menghitung Koefisien Reaksi Reaktan |
Baca juga : Pengertian dan Jenis Jenis Molekul Beserta Contohnya
- Langkah penyetaraan reaksi redoks selanjutnya ialah menyetarakan atom O yang terdapat di H2O(l). Setelah itu aton H pada H+(aq) juga disetarakan.
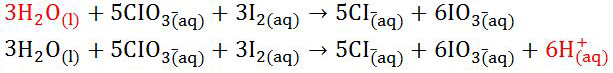 |
| Menyetarakan Atom |
- Langkah penyetaraan reaksi redoks selanjutnya pada reaktan ditambahkan dengan atom OH-(aq) dan untuk jumlah bagian produknya disesuaikan dengan jumlah pada atom H+(aq).
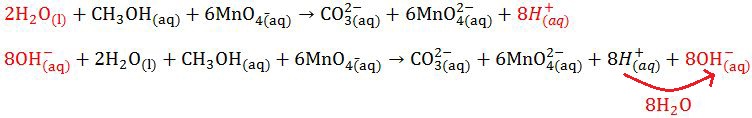 |
| Menambahkannya Dengan Atom |
- Atom H+(aq) dikombinasikan dengan OH-(aq) sehingga mempunyai bentuk persamaan H2O(l) di sisinya. Setelah itu dikedua sisi yang sama sama memiliki jumlah H2O(l) dihilangkan.
| Mengkombinasikan Atom |
Metode Ion Elektron
Penyetaraan reaksi redoks selanjutnya dapat menggunakan metode ion elektron. Adapun tata cara untuk menyetarakannya yaitu sebagai berikut:
- Pertama bentuk reaksinya dibagi menjadi dua yakni reaksi oksidasi dan reaksi reduksi.
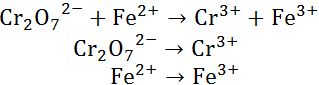 |
| Membagi Bentuk Reaksi Menjadi Dua |
- Kedua bentuk reaksi tersebut disetarakan atom atomnya kecuali atom H maupun O.
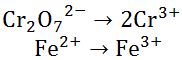 |
| Menyetarakan Atom Selain H dan O |
Baca juga : Pengertian Larutan Elektrolit Kuat dan Elektrolit Lemah Beserta Perbedaannya
- Menyetarakan atom O pada reaksi H2O(l) dan atom H pada reaksi H+(aq).
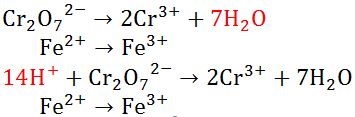 |
| Menyetarakan Atom O dan H |
- Langkah selanjutnya dalam penyetaraan reaksi redoks ialah menyetarakan muatan dalam sebuah elektron (e-).
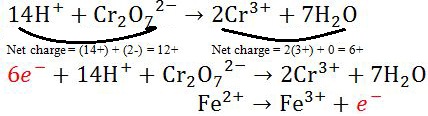 |
| Menyetarakan Muatan Elektron |
- Masing masing setengah reaksi tadi dikalikan koefisiennya sehingga membentuk bilangan bulat. Pada reaksi oksidasi memiliki jumlah pelepasan e- yang sama dengan jumlah penerimaan e- pada reaksi reduksi.
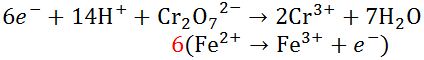 |
| Mengalikan Koefisien |
- Langkah penyetaraan reaksi redoks selanjutnya ialah menggabungkan kedua persamaan tadi menjadi satu reaksi. Setelah itu dikedua sisi persamaannya dihilangkan jumlah spesinya.
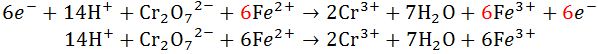 |
| Menggabungkan Reaksi |
- Kemudian reaktan ditambahkan dengan OH-(aq) yang sesuai dengan jumlah pada H+(aq).
| Menambahkan Atom Dalam Reaktan |
- Kedua sisi H+(aq) dikombinasikan sama dengan OH-(aq) sehingga berbentuk H2O(l). Setelah itu di kedua sisinya dihilangkah jumlah H2O(l) nya.
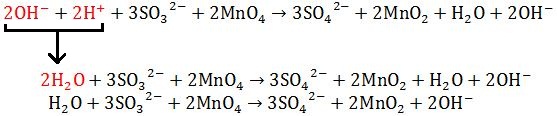 |
| Mengkombinasikan Sisi Sisi Atom |
Contoh dan Fungsi Reaksi Redoks
Setelah membahas tentang pengertian reaksi redoks dan penyetaraan reaksi redoks. Selanjutnya kita akan membahas beberapa fungsi dari reaksi ini. Tentunya bagi yang belum tau seluk beluk reaksi redoks akan bertanya tanya. Sebenarnya apa fungsi reaksi redoks ?
Sebenarnya fungsi reaksi redoks sangat erat kaitannya dengan kehidupan sehari hari. Kita bisa melihat berbagai fungsinya melalui contoh reaksi redoks secara langsung dalam konteks kehidupan nyata. Adapun beberapa fungsinya dapat dilihat dari contoh dalam kehidupan sehari hari yaitu:
- Digunakan untuk pengolahan limbah yang berbahan dasar lumpur aktif.
- Reaksi yang terdapat dalam proses fotosintesis.
- Makanan yang dioksidasi selnya.
- Lapisan zinc pada baut dan mur sehingga logam zinc akan mengalami proses oksidasi dan bagian kationnya akan mengalami reduksi.
- Alat dapur yang terbuat dari stainless steel sehingga permukaan yang terlapisi oksida tidak akan berkarat meskipun terjadi oksidasi yang prosesnya berlanjut.
- Terjadinya fenomena korosi logam beserta cara pencegahannya.
- Membuat asam sulfat untuk kebutuhan industri.
Sekian penjelasan mengenai pengertian reaksi redoks, penyetaraan dan contohnya. Definisi reaksi kategori redoks ialah sebuah bilangan oksidasi yang mengalami perubahan atau sebuah reaksi kimia yang atom atomnya dalam keadaan beroksidasi. Semoga artikel ini dapat menambah wawasan anda dan selamat belajar.