Contoh Soal Rumus Empiris dan Rumus Molekul Beserta Pembahasan – Apa definisi rumus empiris itu? Empiris ialah rumus kimia yang menjelaskan tentang perbandingan pembentuk senyawa dari jumlah atom atom terkecil. Cara menentukan rumus empiris ialah dengan cara menghitung mol komponen penyusun zat melalui massa molarnya. Dalam pembahasan sebelumnya saya telah menjelaskan tentang rumus empiris dan rumus molekul. Kedua rumus ini termasuk dalam rumus kimia dan sering dijadikan sebagai salah satu materi soal soal Ujian Sekolah maupun Ujian Nasional.
 |
| Rumus Kimia (Empiris dan Molekul) |
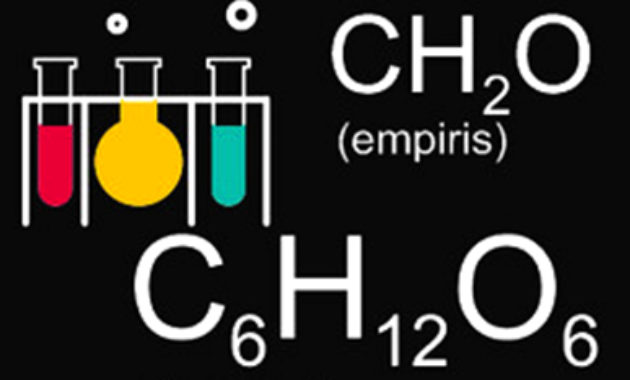
Pengertian rumus molekul berkebalikan dengan rumus empiris yaitu perbandingan sederhana dalam bilangan bulat yang belum tentu merupakan perbandingan penyusun atom atomnya. Contohnya terdapat rumus empiris CH2O diubah dengan kelipatan 6 kalinya menjadi karbohidrat yang rumus molekulnya C6H12O6. Nah pada kesempatan kali ini saya akan membagikan beberapa contoh soal rumus empiris dan rumus molekul beserta pembahasannya. Untuk lebih jelasnya dapat anda simak di bawah ini.
Contoh Soal Rumus Empiris dan Rumus Molekul Beserta Pembahasan
Pada dasarnya materi yang berkaitan dengan cara menghitung molekul mulai diajarkan pada siswa ketika menginjak bangku SMP dan SMA. Lebih tepatnya, kalian akan menjumpainya sebagai bagian dari materi kimia yang cukup kompleks. Meski sudah dibekali penjelasan guru serta teori tertulis di buku pedoman kimia. Tapi masih banyak siswa kesulitan ketika diminta mengerjakan soal empiris karena tak hafal rumus hitungnya.
Berdasarkan masalah inilah akhirnya saya memutuskan untuk membahas lebih dalam bagaimana cara menghitung soal molekul menggunakan rumus empiris. Untuk lebih jelasnya silahkan kalian simak artikel di bawah sampai selesai.
Rumus Empiris dan Molekul
Sebelum membagikan beberapa contoh rumus empiris dan rumus molekul, saya akan menjelaskan terlebih dahulu mengenai cara menentukan rumus empiris dan cara menentukan rumus molekul. Untuk menghitung rumus empiris sebuah senyawa dapat menggunakan rumus di bawah ini:
 |
| Rumus Empiris |
Keterangan :
nA = jumlah mol pada unsur A
nB = jumlah mol pada unsur B
mA = massa unsur A
mB = massa unsur B
ArA = massa atom relatif pada unsur A
ArB = massa atom relatif pada unsur B
Baca juga : 45 Contoh Perubahan Kimia Beserta Penjelasan Lengkap
Jika senyawa disusun oleh tiga unsur, maka ketiga unsur tersebut harus dibandingkan agar memperoleh rumus empirisnya. Dengan begitu contoh soal rumus empiris dan rumus molekul dapat diselesaikan dengan baik. Secara sistematis terdapat rumus empiris lainnya jika diketahui tiga unsur pembentuk senyawa yaitu sebagai berikut:
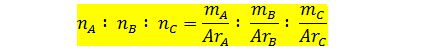 |
| Rumus Empiris Untuk Tiga Unsur Pembentuk Senyawa |
Keterangan :
nA = jumlah mol pada unsur A
nB = jumlah mol pada unsur B
nC = jumlah mol pada unsur C
mA = massa unsur A
mB = massa unsur B
mC = massa unsur C
ArA = massa atom relatif pada unsur A
ArB = massa atom relatif pada unsur B
ArC = massa atom relatif pada unsur C
Dalam contoh soal rumus empiris dan rumus molekul terdapat perhitungan molekul menggunakan rumus tertentu. Cara menentukan rumus molekul sendiri diperoleh apabila diketahui Mr (massa molekul relatif) dan rumus empiris. Rumus ini pada dasarnya adalah jumlah kelipatan rumus dari empirisnya. Maka dari itu secara sistematis rumus molekul dapat ditulis menjadi seperti di bawah ini:
(Rumus Empiris)n = Rumus Molekul
Dalam rumus diatas terdapat n yang merupakan bilangan bulat. Kemudian cara menentukan nilai n harus diketahui Mr (massa molekul relatif) dan rumus empiris terlebih dahulu. Adapun cara menentukan nilai Mr yaitu menggunakan rumus di bawah ini:
Mr rumus molekul = n x (Mr rumus empiris)
Contoh Soal dan Pembahasan Rumus Empiris/Molekul
Agar anda lebih memahami tentang rumus kimia ini. Maka saya akan membagikan beberapa contoh soal rumus empiris dan rumus molekul beserta pembahasannya. Berikut contohnya yaitu meliputi:
1. Kandungan suatu sampel senyawa terdapat unsur Hidrogen 4 gram dan unsur Oksigen 32 gram. Jika Ar H = 1 dan Ar O = 16, tentukan rumus empirisnya?
Pembahasan
Diketahui : mH = 4 gr; mO =32 gr; ArH = 1; ArO= 16
Ditanyakan : Rumus Empiris = ?
Jawab.
 |
| Jawaban Contoh Soal Empiris dan Rumus Molekul #1 |
Jadi rumus empiris sampel senyawa tersebut ialah H2O.
2. Senyawa Hidrokarbon memiliki kandungan H = 4 gram dan C = 24 gram. Jika massa molekul relatifnya 42 pada rumus molekulnya, maka tentukan rumus molekul senyawa tersebut? (Ar H = 1 dan Ar C = 12)
Baca juga : Sifat Sifat Unsur, Senyawa dan Campuran Beserta Contoh Lengkap
Pembahasan
Diketahui : mH = 4 gr; mC =24 gr; ArH = 1; ArC= 12; Mr rumus molekul = 42
Ditanyakan : Rumus Molekul= ?
Jawab: Hal pertama yang harus kita lakukan ialah menentukan rumus empirisnya terlebih dahulu. Adapun caranya yaitu:
 |
| Jawaban Contoh Soal Empiris dan Molekul #2 |
Maka diperoleh rumus empiris senyawa yaitu H2C.
Kemudian menghitung Mr dari rumus empiris senyawa H2C yaitu:
Mr H2C = (2 x Ar H) + (1 x ArC)
Mr H2C = (2 x 1) + (1 x 12) = 14
Setelah itu menentukan rumus molekul dengan menggunakan cara di bawah ini:
Mr rumus molekul = n × (Mr rumus empiris)
42 = n x 14
n = 42/14
n = 3
Rumus molekul = Rumus Empiris x n
= (H2C)3 = H6C3
Jadi rumus molekul senyawa tersebut ialah H6C3.
3. Komposisi senyawa Hidrokarbon terdiri dari unsur karbon 96% dan unsur hidrogen 4%. Apabila Ar C = 12 dan Ar h =1, maka tentukan rumus empiris senyawa tersebut?
Pembahasan
Diketahui :
Unsur Karbon = 96% x 100 = 96 gram
Unsur Hidrogen = 4% x 100 = 4 gram
Ar C = 12 dan Ar h =1
Ditanyakan : Rumus Empiris = ?
Jawab.
 |
| Jawaban Contoh Soal Empiris dan Molekul #3 |
Jadi rumus empiris senyawa tersebut ialah C2H.
Inilah penjelasan mengenai contoh soal rumus empiris dan rumus molekul beserta pembahasannya. Pada dasarnya rumus Kimia dapat dibagi menjadi dua bentuk rumus yaitu Empiris dan Molekul. Semoga artikel ini dapat bermanfaat dan terima kasih telah telah membaca materi Empiris dan Molekul di atas.