Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi – Dalam pelajaran Kimia terdapat materi mengenai Molekul. Molekul sendiri memiliki susunan dari beberapa atom unsur tertentu yang jumlahnya juga tertentu. Molekul memiliki bentuk geometris yang berasal dari hubungan inti atom unsur dengan molekul lainnya melalui garis lurus. Biasanya susunan ruang dalam pasangan elektron akan menentukan bentuk dari molekul senyawa kovalen yang berada di sekitar atom pusat. Bagaimana bentuk dari molekul menurut teori domain elektron? Bagaimana bentuk dari molekul menurut teori hibridisasi?
Penguraian bentuk dari molekul senyawa kovalen ditentukan oleh teori domain elektron (VSEPR) dan teori hibridisasi. Bentuk molekul menurut teori domain elektron memang berbeda dengan bentuk dari molekul menurut teori hibridisasi. Hal ini dikarenakan kedua jenis teori tersebut juga memiliki pengertian yang berbeda. Bahkan konsep kedua teori ini juga berbeda. Molekul tersebut memiliki bentuk yang merupakan gambaran mengenai beberapa atom yang disusun menjadi sebuah molekul tersebut. Selain itu juga didasarkan pada susunan dalam ruang pasangan elektron di molekul atau atom itu sendiri, baik pasangan elektron yang berikatan ataupun bebas.
 |
| Bentuk Bentuk dari Sebuah Molekul |
Bentuk sebuah molekul dapat ditentukan menurut beberapa teori seperti teori domain elektron dan teori hibridisasi. Pada kesempatan kali ini saya akan menjelaskan tentang bentuk bentuk molekul menurut teori domain elektron dan bentuk dari molekul menurut teori hibridisasi. Untuk lebih jelasnya dapat anda simak di bawah ini.
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi
Pengertian molekul ialah gugusan yang berasal dari dua atom atau lebih disusun menggunakan ikatan kimia agar saling berhubungan secara elektris netral. Untuk menentukan bentuk dari molekul tersebut dapat menggunakan teori domain elektron maupun teori hibridisasi. Bentuk suatu molekul tersebut biasanya berpengaruh banyak terhadap sifat kimia dan fisis dari molekul itu sendiri, terutama untuk reaksi kimianya. Sebuah reaksi akan terjadi ketika terdapat pencampuran kedua molekul. Namun terdapat kemungkinan bahwa reaksi tidak dapat berhasil jika ada ketidaktepatan dalam struktur orientasi dan tiga dimensi dari molekul molekul itu.
Baca juga : Indikator, Derajat Keasaman, dan Tetapan Kesetimbangan Air Lengkap
Kita tahu bahwa struktur molekul dalam reaksi biologi cukup penting digunakan untuk mengetahui kecocokan dalam penggunaan membran atau tapak dengan bentuk dari molekulnya, khususnya pada aktivitas enzim dan obat. Di bawah ini terdapat penjelasan mengenai bentuk bentuk molekul menurut teori domain elektron dan bentuk dari molekul menurut teori hibridisasi yaitu sebagai berikut:
Teori Domain Elektron
Pengertian domain elektron ialah sebuah daerah elektron yang menempati molekul tersebut. Teori domain elektron berisi pernyataan tentang pasangan elektron bebas tolak menolak dengan pasangan elektron ikatan sehingga satu sama lain saling berjauhan antar pasangan masing masing agar gaya tolakannya dapat diminimalisir. Dengan kata lain, pasangan elektron bebas (PEB) dan pasangan elektron ikatan (PEI) akan disusun menjadi ruang yang mempengaruhi bentuk dari molekul tersebut di atom pusatnya. Teori ini dapat disebut sebagai teori Tolakan Pasangan Elektron Valensi atau teori Valence Shell Electron Pair Repulsion (VSEPR).
Pada tahun 1957 terdapat pengembangan teori VSEPR pertama kali oleh R.J. Gillespie (ahli kimia Kanada) sesuai dengan ide dari H. Powel dan N. Sigewick (ahli kimia inggris). Bentuk molekul menurut teori domain elektron merupakan teori VSEPR yang disempurnakan. Domain elektron sendiri diartikan sebagai daerah tempat elektron berada atau kedudukan elektron dengan jumlah domain tertentu. Adapun jumlah domain pada domain elektron yaitu meliputi:
- Satu domain untuk masing masing pasangan elektron bebas.
- Satu domain untuk masing masing elektron ikatan, baik ikatan rangkap tiga, tunggal, maupun rangkap dua.
Pada dasarnya pasangan elektron terikat yang menentukan bentuk dari molekul tersebut. Bentuk dasar molekul kovalen sendiri terdiri dari beberapa macam seperti linear, segitiga dasar, tetahedral, trigonal bipiramida, dan oktahedral. Kemudian untuk meramalkan bentuk molekul dapat menggunakan metode rumus titik elektron yang dikembangkan menjadi teoori VSEPR (teori tolakan pasangan elektron kulit valensi) atau teori domain elektron. Di dalam teori domain telektron tersebut terdapat pengemasan seperangkat aturan yang membuat bentuk dari molekul itu dapat diramalkan dengan tepat. Teori tersebut sesuai dengan jumlah pasangan elektron bebas dan pasangan elektron ikatan sebuah molekul yang terdapat di kulit valensi atom pusatnya.
Baca juga : Contoh Soal Rumus Empiris dan Rumus Molekul Beserta Pembahasan
Bentuk molekul menurut teori domain elektron disesuaikan dengan menggunakan tolakan pasangan elektron di kulit valensi atom pusatnya. Maka dari itu jenis teori molekul tersebut dapat dinamakan dengan VSEPR atau domain elektron. Bagaimana bentuk dari molekul dapat diprediksi menggunakan teori ini? Di bawah ini terdapat beberapa jenis molekul yang mempunyai atom pusat seperti di bawah ini:
- Molekul berikatan kovalen rangkap.
- Molekul berikatan tunggal, tetapi jenuh.
- Molekul berikatan tunggal, tetapi tidak jenuh karena didalamnya mempunyai elektron bebas.
PEB menghasilkan gaya tolakan dalam teori VSEPR yang berpengaruh terhadap bentuk dari suatu molekul. Kemudian jumlah PEB dan PEI ditunjukkan dalam notasi VSEPR seperti di bawah ini:
Bentuk molekul menurut teori domain elektron memang memiliki hubungan dengan PEB dan PEI. Di bawah ini terdapat beberapa bentuk suatu molekul menurut teori domain elektron yaitu sebagai berikut:
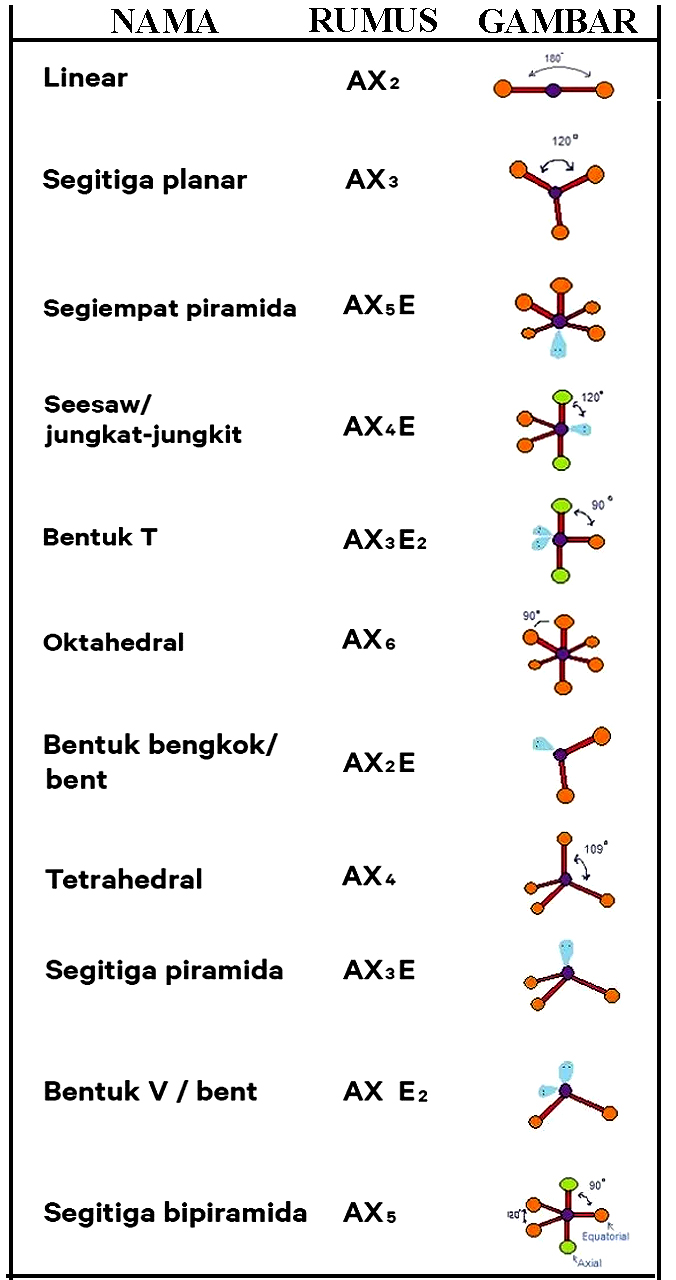 |
| Tabel Bentuk Suatu Molekul Menurut Teori Domain Elektron |
Baca juga : Rumus Empiris dan Rumus Molekul Beserta Contoh Soal
Teori Hibridisasi
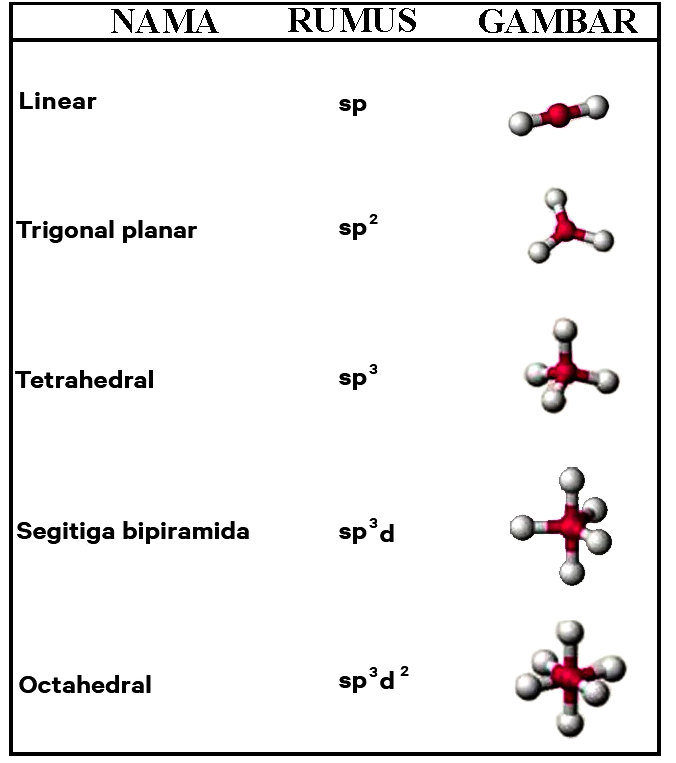
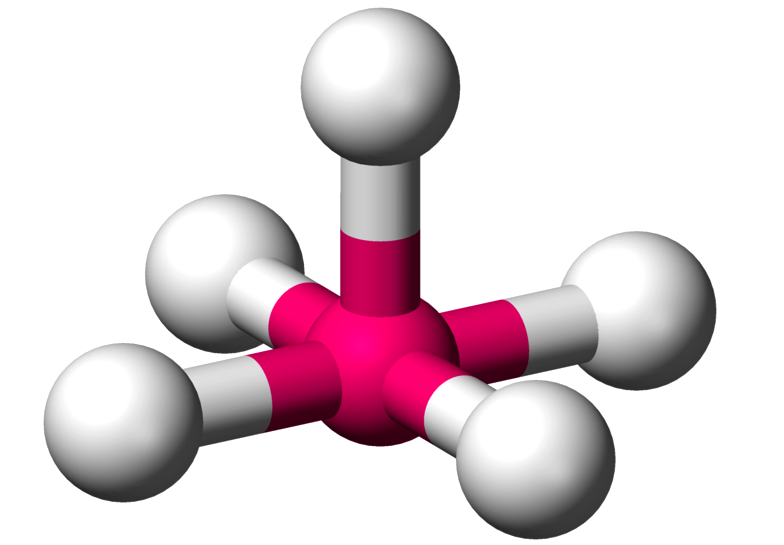
Selanjutnya saya akan menjelaskan tentang bentuk molekul menurut teori hibridisasi. Teori hibridisasi ialah teori yang terdapat hubungan antar elektron dalam proses menggabungkan beberapa orbital atom. Adapun beberapa orbital yang digabungkan seperti orbital sp², orbital hibrida sp, orbital sp³d²dan sp³d, serta orbital sp³. Teori hibridisasi dapat dinamakan dengan teori ikatan valensi. Di bawah ini terdapat beberapa bentuk suatu molekul menurut teori hibridisasi yaitu sebagai berikut:
|
|
Sekian penjelasan mengenai bentuk bentuk molekul menurut teori domain elektron dan bentuk dari molekul menurut teori hibridisasi. Molekul memiliki bentuk yang didasarkan pada kedua jenis teori tersebut. Semoga artikel ini dapat menambah wawasan anda dan terima kasih telah berkunjung di blog ini.